Агляд
Хуткая ідэнтыфікацыя трансгенных раслін
Тэкст/Тун Юйчэн
Эксперыментальная эксплуатацыя / Хань Ін
Рэдактар / Вэнь Юцзюнь
Словы/1600+
Прапанаваны час чытання/8-10 хвілін
Хуткая ідэнтыфікацыя трансгенных раслін
Як пачатковец у лабараторыі, гэта не вельмі добрая праца, каб адсеяць станоўчыя расліны з групы раслін з нізкім каэфіцыентам канверсіі.Спачатку трэба вылучыць ДНК з вялікай колькасці ўзораў адзін за адным, а затым чужародныя гены выяўляюць метадам ПЦР.Тым не менш, вынікі часта бываюць пустымі і час ад часу палосамі з некалькімі элементамі, але немагчыма вызначыць, ці ёсць прапушчаныя або ілжывыя выяўлення..Ці вельмі бездапаможна сутыкнуцца з такім эксперыментальным працэсам і вынікамі?Не хвалюйцеся, брат навучыць вас, як лёгка і дакладна адсеяць трансгенныя станоўчыя расліны.
Крок 1: Праймеры для выяўлення дызайну
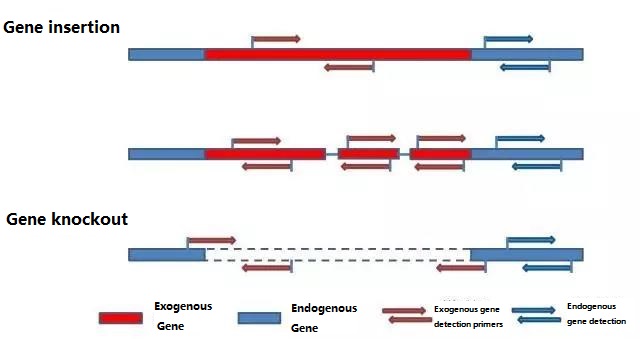
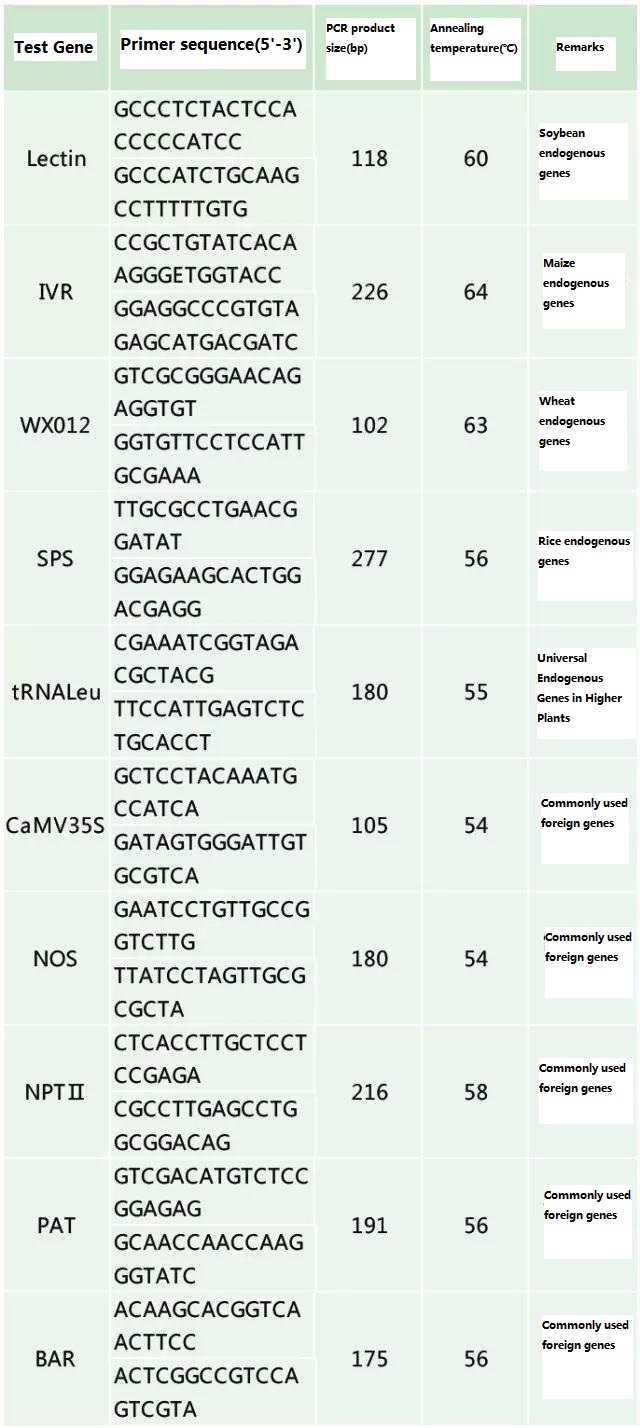
Вызначце эндагенны ген і экзагенны ген, якія трэба выявіць, у адпаведнасці з узорам, які падлягае тэсціраванню, і абярыце рэпрэзентатыўную паслядоўнасць 100-500 п.н. у гене для распрацоўкі праймера.Добрыя праймеры могуць забяспечыць дакладнасць вынікаў выяўлення і скараціць час выяўлення (гл. дадатак для праймераў выяўлення, якія звычайна выкарыстоўваюцца).
нататка:
Нядаўна распрацаваныя праймеры павінны аптымізаваць умовы рэакцыі і праверыць дакладнасць, дакладнасць і мяжу выяўлення перад выкананнем буйнамаштабнага выяўлення.
крок 2:Распрацуйце пратакол эксперыменту

Станоўчы кантроль: выкарыстоўвайце вычышчаную ДНК, якая змяшчае мэтавы фрагмент, у якасці шаблону, каб вызначыць, ці нармальныя сістэма і ўмовы рэакцыі ПЦР.
Адмоўны/пусты кантроль: выкарыстоўвайце шаблон ДНК або ddH2O, які не змяшчае мэтавага фрагмента ў якасці шаблону для вызначэння наяўнасці крыніцы заражэння ў сістэме ПЦР.
Унутраны эталонны кантроль: выкарыстоўвайце камбінацыю праймера/зонда эндагеннага гена ўзору, які падлягае тэсціраванню, каб ацаніць, ці можна выявіць шаблон метадам ПЦР.
нататка:
Станоўчы, адмоўны/пусты кантроль і ўнутраны кантроль павінны быць устаноўлены для кожнага тэсту, каб ацаніць сапраўднасць вынікаў эксперыменту.
Крок 3: Падрыхтоўка доследу

Перад выкарыстаннем прасачыце, ці раўнамерна змяшаны раствор.Пры выпадзенні асадка перад ужываннем яго неабходна растварыць і змяшаць у адпаведнасці з інструкцыяй.Сумесь 2 × ПЦР неабходна некалькі разоў змяшаць з дапамогай мікрапіпеткі перад выкарыстаннем, каб пазбегнуць нераўнамернага размеркавання іёнаў.
нататка:
Дастаньце інструкцыю і ўважліва прачытайце яе, а перад эксперыментам падрыхтуйцеся ў строгай адпаведнасці з інструкцыяй.
Крок 4: Падрыхтуйце рэакцыйную сістэму ПЦР
Згодна з пратаколам эксперыменту, змяшайце праймеры H2O, 2 × ПЦР змяшаць, цэнтрыфугаваць і размеркаваць іх у кожную рэакцыйную прабірку.
нататка:
Для буйнамаштабнага або доўгатэрміновага тэсціравання рэкамендуецца выкарыстоўваць рэакцыйную сістэму ПЦР, якая змяшчае фермент UNG, які можа эфектыўна пазбегнуць аэразольнага забруджвання, выкліканага прадуктамі ПЦР.
Крок 5: Дадайце шаблон рэакцыі

Пры выкарыстанні тэхналогіі Direct PCR няма неабходнасці ў стомным працэсе ачысткі нуклеінавых кіслот.Шаблон узору можа быць падрыхтаваны на працягу 10 хвілін і дададзены ў адпаведную рэакцыйную сістэму ПЦР.
нататка:
Метад лізісу мае лепшы эфект выяўлення, і атрыманы прадукт можна выкарыстоўваць для некалькіх рэакцый выяўлення.
5.1: Прамая ПЦР лісця
У адпаведнасці з памерам малюнка ў кіраўніцтве адрэжце тканіну ліста дыяметрам 2-3 мм і змесціце яе ў рэакцыйную сістэму ПЦР.
Заўвага: пераканайцеся, што фрагменты лісця цалкам пагружаны ў рэакцыйны раствор для ПЦР, і не дадавайце лішак тканіны лісця.
5.2: Метад лізісу лісця
Адрэжце тканіна ліста дыяметрам 5-7 мм і змесціце яе ў центрифужную прабірку.Калі вы выбіраеце спелыя лісце, пазбягайце выкарыстання тканін галоўнай жылкі ліста.Закапайце 50 мкл лізата буфера P1 у цэнтрыфужную прабірку, каб пераканацца, што лізат можа цалкам пагрузіць тканіну ліста, змесціце яго ў тэрмацыклер або металічную ванну і лізуйце пры 95°C на працягу 5-10 хвілін.


Дадайце 50 мкл нейтралізацыйнага раствора буфера P2 і добра змяшайце.Атрыманы лізат можа быць выкарыстаны ў якасці шаблону і дададзены ў рэакцыйную сістэму ПЦР.
Заўвага: колькасць шаблону павінна складаць 5-10% ад ПЦР-сістэмы і не павінна перавышаць 20% (напрыклад, у 20-мкл ПЦР-сістэму дадайце 1-2 мкл буфера для лізісу, не больш за 4 мкл).
Крок 6: рэакцыя ПЦР

Пасля цэнтрыфугавання рэакцыйнай прабіркі ПЦР змесціце іх у прыбор ПЦР для ампліфікацыі.
нататка:
У рэакцыі для ампліфікацыі выкарыстоўваецца неачышчаная матрыца, таму колькасць цыклаў ампліфікацыі на 5-10 больш цыклаў, чым пры выкарыстанні ачышчанай матрыцы ДНК.
Крок 7: Выяўленне электрафарэзу і аналіз вынікаў

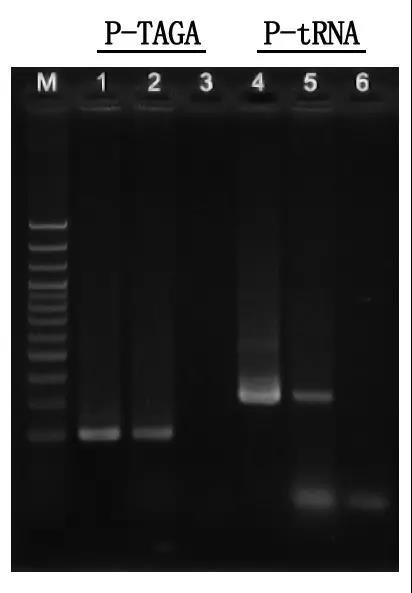
M: Лесвіца ДНК 100 bp
1\4: Метад вычышчанай ДНК
2\5: Прамы метад ПЦР
3\6: пусты кантроль
Кантроль якасці:
Вынікі выпрабаванняў розных элементаў кіравання, устаноўленых у эксперыменце, павінны адпавядаць наступным умовам.У адваротным выпадку трэба прааналізаваць прычыну праблемы і правесці паўторны тэст пасля ліквідацыі праблемы.
Табліца 1. Нармальныя вынікі аналізаў розных кантрольных груп

*Калі плазміда выкарыстоўваецца ў якасці станоўчага кантролю, вынік тэсту на эндагенны ген можа быць адмоўным
Вынік:
А. Вынік тэсту эндагеннага гена ўзору адмоўны, што паказвае на тое, што ДНК, прыдатную для звычайнага выяўлення ПЦР, не можа быць выдзелена з узору або вынятая ДНК утрымлівае інгібітары ПЦР-рэакцыі, і ДНК трэба вылучыць яшчэ раз.
B. Вынік тэсту эндагеннага гена ўзору з'яўляецца станоўчым, а вынік тэсту экзагеннага гена - адмоўным, што сведчыць аб тым, што ДНК, прыдатная для звычайнага ПЦР-дэтэктара, вылучана з узору, і можна меркаваць, што ген ХХХ ва ўзоры не выяўлены.
C. Вынік тэсту эндагеннага гена ўзору станоўчы, а вынік тэсту экзагеннага гена станоўчы, што паказвае на тое, што ДНК, прыдатная для звычайнага ПЦР-дэтэктара, была выдзелена з узору, і ДНК ўзору змяшчае ген XXX.Пацвярджаючыя эксперыменты могуць быць праведзены далей.
Крок 8: Праймеры для выяўлення дызайну

Пасля эксперыменту выкарыстоўвайце 2% раствор гіпахларыту натрыю і 70% раствор этанолу, каб працерці эксперыментальную зону, каб прадухіліць забруджванне навакольнага асяроддзя.
дадатак
Табліца 2. Звычайна выкарыстоўваюцца праймеры для агульнай ПЦР-дэтэкцыі генетычна мадыфікаваных раслін
Даведачны дакумент:
SN/T 1202-2010, Метад якаснага выяўлення ПЦР генетычна мадыфікаваных раслінных інгрэдыентаў у прадуктах харчавання.
Аб'ява Міністэрства сельскай гаспадаркі 1485-5-2010, Тэставанне інгрэдыентаў генетычна мадыфікаваных раслін і прадуктаў з іх - рыс M12 і яго вытворныя.
Час публікацыі: 9 чэрвеня 2021 г








