Зыходны матэрыял: РНК
Колькасная ПЦР са зваротнай транскрыпцыяй (RT-qPCR) - гэта эксперыментальны метад, які выкарыстоўваецца ў эксперыментах ПЦР з выкарыстаннем РНК у якасці зыходнага матэрыялу.У гэтым метадзе агульная РНК або інфармацыйная РНК (мРНК) спачатку транскрыбуецца ў камплементарную ДНК (кДНК) з дапамогай зваротнай транскрыптазы.Пасля была праведзена рэакцыя qPCR з выкарыстаннем кДНК у якасці матрыцы.RT-qPCR выкарыстоўвалася ў розных сферах малекулярнай біялогіі, уключаючы аналіз экспрэсіі генаў, праверку РНК-інтэрферэнцыі, праверку мікрачыпаў, выяўленне патагенаў, генетычнае тэставанне і даследаванне хвароб.
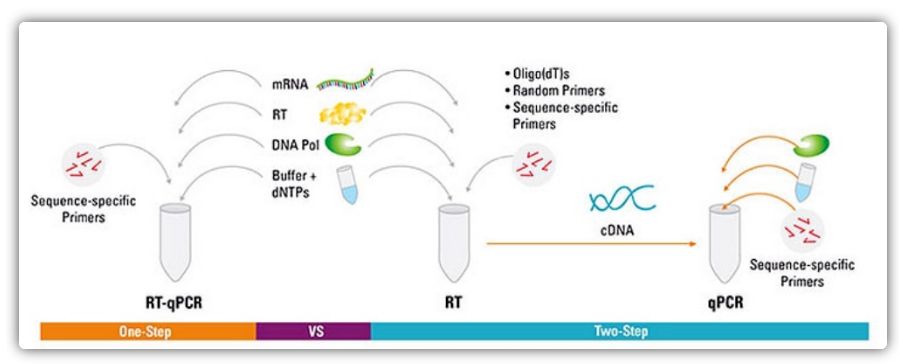
Аднаэтапны і двухэтапны метады RT-QPCR
RT-qPCR можа быць выканана аднаэтапным або двухэтапным метадам.Аднаэтапная RT-qPCR спалучае зваротную транскрыпцыю і ПЦР-ампліфікацыю, дазваляючы зваротнай транскрыптазе і ДНК-палімеразе завяршыць рэакцыю ў адной прабірцы пры аднолькавых буферных умовах.Аднаэтапная RT-qPCR патрабуе толькі выкарыстання праймераў, спецыфічных для паслядоўнасці.У двухэтапнай RT-qPCR зваротная транскрыпцыя і ПЦР-ампліфікацыя выконваюцца ў дзвюх прабірках з выкарыстаннем розных аптымізаваных буфераў, умоў рэакцыі і стратэгій распрацоўкі праймераў.
| Перавага | Недахоп | |
| Адзін крок | Гэты метад мае меншую эксперыментальную памылку, паколькі абедзве рэакцыі праводзяцца ў адной прабірцы
Меншая колькасць этапаў піпетавання зніжае рызыку заражэння
Падыходзіць для высокапрадукцыйнага ўзмацнення/скрынінгу, хуткі і ўзнаўляльны | Двухэтапныя рэакцыі нельга аптымізаваць асобна
Паколькі ўмовы рэакцыі пагаршаюцца спалучэннем двухэтапнай рэакцыі, адчувальнасць не такая добрая, як у двухэтапнага метаду
Колькасць мэтаў, выяўленых адным узорам, невялікая |
| Два крокі | Магчымасць ствараць стабільныя бібліятэкі кДНК, якія можна захоўваць на працягу доўгага перыяду часу і выкарыстоўваць у шматлікіх рэакцыях
Гены-мішэні і эталонныя гены можна ампліфікаваць з адной і той жа бібліятэкі кДНК без неабходнасці выкарыстання некалькіх бібліятэк кДНК
Рэакцыйныя буферы і ўмовы рэакцыі, якія дазваляюць аптымізаваць адзіночныя прагоны рэакцыі
Гнуткі выбар умоў запуску | Выкарыстанне некалькіх прабірак і больш этапаў піпетавання павялічвае рызыку заражэння ДНК, і займае шмат часу.
Патрабуецца больш аптымізацыі, чым аднаэтапны метад |
Спадарожныя тавары:
RT-qPCR Easyᵀᴹ (адзін крок)-SYBR Green I
RT-qPCR Easyᵀᴹ (адзін крок)-Такман
RT Easyᵀᴹ I Майстар-прэмікс для сінтэзу першай ніткі CDNA
ПЦР у рэальным часе Easyᵀᴹ-SYBR Green I Kit
ПЦР у рэжыме рэальнага часу Easyᵀᴹ-Taqman
Вылучэнне агульнай РНК і мРНК
Пры распрацоўцы эксперыменту RT-qPCR важна вырашыць, выкарыстоўваць татальную РНК або вычышчаную мРНК у якасці шаблону для зваротнай транскрыпцыі.Хаця мРНК можа забяспечыць крыху больш высокую адчувальнасць, татальная РНК па-ранейшаму часта выкарыстоўваецца.Прычына гэтага ў тым, што агульная РНК мае больш важную перавагу ў якасці зыходнага матэрыялу, чым мРНК.Па-першае, працэс патрабуе меншай колькасці этапаў ачысткі, што забяспечвае лепшае колькаснае аднаўленне шаблону і лепшую нармалізацыю вынікаў да зыходных нумароў ячэек.Па-другое, гэта пазбягае этапу ўзбагачэння мРНК, які можа пазбегнуць магчымасці скажоных вынікаў з-за рознага аднаўлення розных мРНК.У цэлым, паколькі ў большасці прыкладанняў адносная колькасная ацэнка гена-мішэні больш важная, чым абсалютная адчувальнасць выяўлення, агульная РНК больш падыходзіць у большасці выпадкаў.
Праймер для зваротнай транскрыпцыі
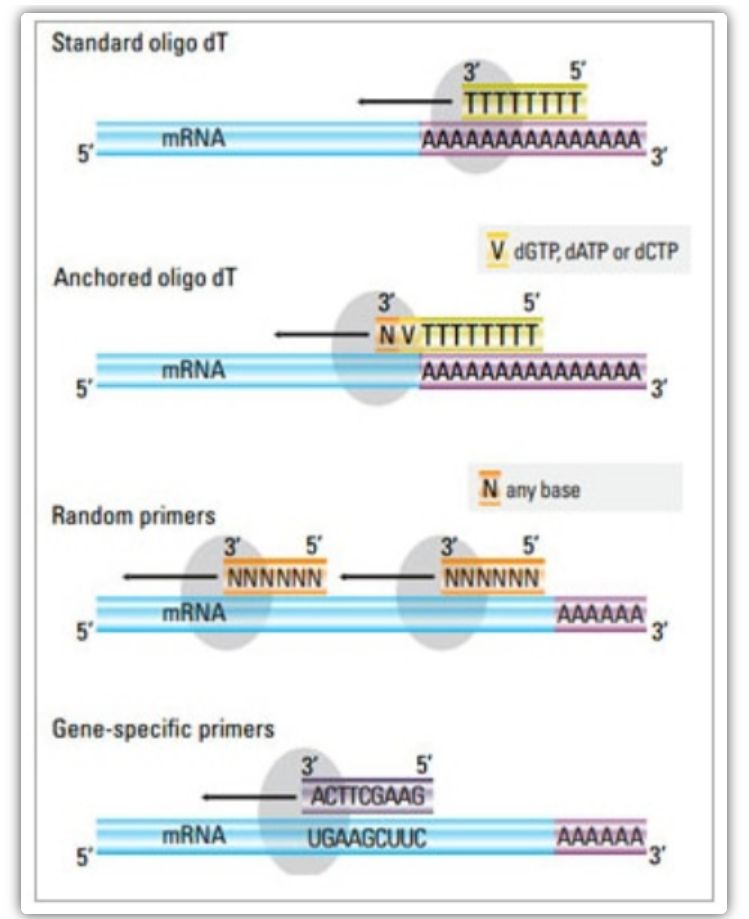
У двухэтапным метадзе можна выкарыстоўваць тры розныя метады для праймера рэакцыі кДНК: аліга(dT) праймеры, выпадковыя праймеры або праймеры, спецыфічныя для паслядоўнасці.Як правіла, аліга(dT) праймеры і выпадковыя праймеры выкарыстоўваюцца ў камбінацыі.Гэтыя праймеры адпальваюцца з матрычнай ланцугом мРНК і забяспечваюць зваротную транскрыптазу зыходнай кропкай для сінтэзу.
| Выбар грунтоўкі | Будова і функцыі | Перавага | Недахоп |
| Аліга(dT) праймер (або замацаваны аліга(dT) праймер) | Пашыраны адпал да рэшткаў тыміну ў хвасце полі(А) мРНК;якарны аліга(dT) праймер змяшчае G, C або A на 3'-канцы (сайт якара) | Сінтэз поўнапамернай кДНК з мРНК з полі(А)-хвостам
Ужываецца пры меншай колькасці зыходнага матэрыялу
Сайт замацавання гарантуе, што аліга(dT) праймер звязваецца з 5' полі(А) хвастом мРНК | Падыходзіць толькі для ампліфікацыі генаў з полі(А) хвастамі
Атрымайце кДНК, усечаную з сайта прайміравання*2 у полі(А)
Змешчаны для прывязкі да 3'-канца*
*Гэтая магчымасць зведзена да мінімуму, калі выкарыстоўваюцца замацаваныя аліга(dT) праймеры |
| выпадковы буквар
| Ад 6 да 9 асноў у даўжыню, якія могуць адпальвацца ў некалькіх месцах падчас транскрыпцыі РНК | Адпал з усімі РНК (тРНК, рРНК і мРНК)
Падыходзіць для транскрыптаў са значнай другаснай структурай або калі даступна менш зыходнага матэрыялу
Высокі выхад кДНК | кДНК адваротна транскрыбуецца з усіх РНК, што звычайна непажадана і можа аслабіць сігнал мРНК-мішэні
атрымаць усечаную кДНК |
| паслядоўна-спецыфічныя праймеры | Карыстальніцкія праймеры, накіраваныя на пэўныя паслядоўнасці мРНК | спецыфічная бібліятэка кДНК
Палепшыць адчувальнасць
Выкарыстанне зваротных праймераў qPCR | Толькі абмяжоўваецца сінтэзам аднаго гена-мішэні |
Зваротная транскриптаза
Зваротная транскрыптаза - гэта фермент, які выкарыстоўвае РНК для сінтэзу ДНК.Некаторыя зваротныя транскрыптазы валодаюць актыўнасцю РНКазы і могуць дэградаваць ланцугі РНК у гібрыдных ланцугах РНК-ДНК пасля транскрыпцыі.Калі ён не мае ферментатыўнай актыўнасці РНКазы, можна дадаць РНКазу для павышэння эфектыўнасці кПЦР.Звычайна выкарыстоўваюцца ферменты ўключаюць зваротную транскрыптазу віруса мышынага лейкозу Молоні і зваротную транскрыптазу віруса міелабластомы птушак.Для RT-qPCR ідэальна выбраць зваротную транскрыптазу з больш высокай тэрмастабільнасцю, каб сінтэз кДНК можна было выконваць пры больш высокіх тэмпературах, забяспечваючы паспяховую транскрыпцыю РНК з больш высокай другаснай структурай, захоўваючы пры гэтым іх поўную актыўнасць на працягу ўсёй рэакцыі, што прыводзіць да больш высокіх выхадаў кДНК.
Спадарожныя тавары:
Зваротная транскрыптаза Foreasy M-MLV
Актыўнасць РНКазы Н зваротнай транскриптазы
РНКаза H здольная дэградаваць ланцугі РНК з дуплексаў РНК-ДНК, што дазваляе эфектыўна сінтэзаваць двухцепочечную ДНК.Аднак пры выкарыстанні доўгай мРНК у якасці матрыцы РНК можа заўчасна дэградаваць, што прывядзе да ўсечанай кДНК.Такім чынам, часта бывае карысна звесці да мінімуму актыўнасць РНКазы падчас кланіравання кДНК, калі патрэбны сінтэз доўгіх транскрыптаў.Наадварот, зваротныя транскрыптазы з актыўнасцю РНКазы H часта карысныя для прымянення кПЦР, таму што яны ўзмацняюць расплаўленне дуплексаў РНК-ДНК падчас першага цыкла ПЦР.
Афармленне грунтоўкі
ПЦР-праймеры, якія выкарыстоўваюцца на этапе кПЦР у RT-qPCR, у ідэале павінны быць распрацаваны так, каб ахопліваць злучэнне экзон-экзон, дзе праймер для ампліфікацыі патэнцыйна можа ахопліваць фактычную мяжу экзон-інтрон.Паколькі паслядоўнасці геномнай ДНК, якія змяшчаюць інтроны, не ампліфікуюцца, гэтая канструкцыя зніжае рызыку ілжывых спрацоўванняў, якія ўзмацняюцца ў выніку забруджвання геномнай ДНК.
Калі праймеры не могуць быць распрацаваны для падзелу экзонаў або межаў экзон-экзон, магчыма, спатрэбіцца апрацаваць узоры РНК ДНКазай I без РНКазы або dsDNase для выдалення забруджвання геномнай ДНК.
Кантроль RT-qPCR
Адмоўны кантроль зваротнай транскрыпцыі (кантроль -RT) павінен быць уключаны ва ўсе эксперыменты RT-qPCR для выяўлення забруджвання ДНК (напрыклад, геномнай ДНК або прадуктаў ПЦР з папярэдніх рэакцый).Гэты кантроль змяшчае ўсе кампаненты рэакцыі, акрамя зваротнай транскрыптазы.Паколькі зваротная транскрыпцыя не адбываецца з гэтым кантролем, калі назіраецца ПЦР-ампліфікацыя, заражэнне ад ДНК найбольш верагодна.
Час публікацыі: 2 жніўня 2022 г








